- Home
- 大学, 理窓 2023年1月号
- 基礎研究を推し進める東京理科大学の優れた研究所を訪ねて(第10回) 研究推進機構 生命医科学研究所(5)【生命情報システム部門編】
基礎研究を推し進める東京理科大学の優れた研究所を訪ねて(第10回) 研究推進機構 生命医科学研究所(5)【生命情報システム部門編】
- 2023/1/1
- 大学, 理窓 2023年1月号

生命医科学研究所の生命情報システム部門を訪問し中村岳史教授と小園晴生准教授にお話を伺った。
【生命情報システム部門 中村研究室のミッション】
神経ネットワークの形成や再生、および神経細胞の恒常性維持と破綻のメカニズムを理解することを通じて、神経難病の治療法へとつなげることを目指しています。
『中村岳史研究室』
中村研究室では、①神経ネットワークの形成や再生、および②神経細胞の恒常性の維持とその破綻に関わる研究を行っています。私たちの脳には800億個を超える神経細胞が存在し、1つ1つの神経細胞は細胞体と2種類のケーブル(軸索と樹状突起)からできています。神経細胞が複雑な回路を構成して情報をやり取りする際に、2種類のケーブルは入力側が樹状突起、出力側が軸索という役割分担をしています。人間の体にある最も長い軸索は1メートルを超えるため、分子モーターによる軸索での物質輸送にはかなり凝った仕組みが必要になります。神経ネットワークの形成や再生の過程では、細胞体で作られた分子を突起先端に運ぶ順行輸送が重要となります。また、神経細胞の健康を保つためには、細胞の機能障害を引き起こす変性タンパク質を突起先端から細胞体に逆行輸送して分解装置で壊す働きが不可欠になります。私の研究室では、これらの輸送過程を制御する機構の中心として働くG蛋白質の活性を可視化するセンサーを開発して研究に用いています。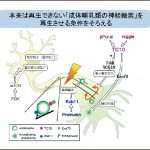 ①のテーマでは、可視化センサーにより輸送時の活性変化を見出したTC10 G蛋白質が、実は、損傷を受けた軸索の再生に必須な分子であることをマウスの系で最近明らかにしました。中枢神経の軸索再生に関わる因子はまだ少数しか報告されておらず、再生の全体像を把握するための有用な手掛かりになると考えています。②のテーマに関連して重要なことは、変性タンパク質を逆行輸送して細胞体で壊す仕組みが破綻すると、毒性のある凝集体が神経細胞内に蓄積して神経変性疾患の発症に関わるという点です。逆行輸送の制御に関わるRab5やRab7といったG蛋白質の活性異常に注目することで、輸送障害と神経変性疾患の発症の間のつながりを明らかにすることを目指して研究を行っています。
①のテーマでは、可視化センサーにより輸送時の活性変化を見出したTC10 G蛋白質が、実は、損傷を受けた軸索の再生に必須な分子であることをマウスの系で最近明らかにしました。中枢神経の軸索再生に関わる因子はまだ少数しか報告されておらず、再生の全体像を把握するための有用な手掛かりになると考えています。②のテーマに関連して重要なことは、変性タンパク質を逆行輸送して細胞体で壊す仕組みが破綻すると、毒性のある凝集体が神経細胞内に蓄積して神経変性疾患の発症に関わるという点です。逆行輸送の制御に関わるRab5やRab7といったG蛋白質の活性異常に注目することで、輸送障害と神経変性疾患の発症の間のつながりを明らかにすることを目指して研究を行っています。
『小園晴生研究室』
小園研究室では、免疫系タンパク質の構造に基礎を置く免疫応答の解析を行っている。特にT細胞受容体のリガンドであるMHC/ペプチド複合体の安定性がT細胞活性化にどのように影響を与えるか、それを免疫病の治療に活かすにはどうしたらいいか検討している。またその解決のために抗原特異的T細胞を検出する方法の開発を行っている。
当研究室の研究の背景となる生命現象は、免疫細胞が自分の体を誤って攻撃する自己免疫疾患である。免疫応答の過剰によって生じる自己免疫疾患は、自分の体に存在するタンパク質を認識して攻撃するT細胞が生まれることによっておこる。本来、自己反応性のT細胞は胸腺での負の選択により排除される。しかしながら、完全に排除してしまうと外来抗原に対する準備状況も悪くなってしまう。故に末梢T細胞の半数近くは自己とも反応すると見積もられている。つまり、我々の体は自己免疫が容易に起こりうる状況にある。それでも自己免疫は通常は回避されている。
自己免疫の回避に重要なのが制御性T細胞による自己反応性T細胞の抑制である。この制御性T細胞の生まれる仕組みは様々であるが、当研究室ではリガンドの安定性の強弱が末梢での制御性T細胞の誘導を左右すると考えている。現在、MHCに結合する抗原ペプチドの種類や、MHCのユビキチン化という翻訳後修飾の一つがT細胞受容体のリガンドとしてのMHC分子の安定性に影響を与え、制御性T細胞を生み出すことを実証しつつある。
活性化してしまった自己反応性のT細胞を検出する方法として用いているのはMHCマルチマーである。私は、アメリカ留学中に可溶性のMHCとペプチド抗原が共有結合した分子を作り、それを利用して世界初のClass II MHCテトラマーを作ることができた。これらを利用して自己反応性のT細胞を未病のうちに除く技術を開発する。












